Cookie instellingen
Wij maken gebruik van cookies. Indien je op akkoord klikt geef je hiervoor toestemming. Lees onze cookieverklaring voor meer informatie. Daar is ook de mogelijkheid om aan te geven welke cookies je accepteert.
26 maart 2022
Om het gedrag van nucleaire geneeskunde in het lichaam na toediening te voorspellen, heeft Ramona Bouwman, adviseur stralingsbescherming bij NRG, een biokinetisch model ontwikkeld. Het model is getest met patiëntgegevens van het Antoni van Leeuwenhoek en de resultaten zijn veelbelovend.
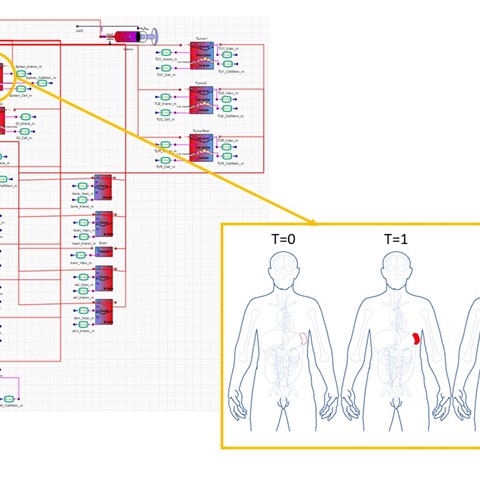

Bouwman heeft een achtergrond in de toegepaste natuurkunde en werkt sinds 2019 aan dit model. Een biokinetisch model is een set van wiskundige formules, die het gedrag beschrijven van materialen die bedoeld of onbedoeld het lichaam binnenkomen. Ze worden gebruikt om de tijdsafhankelijke verdeling van materialen in het lichaam tot op subcel niveau en hun eliminatie langs specifieke uitscheidingsroutes te voorspellen. “Deze modellen voorspellen wat er in het lichaam gebeurt tijdens de behandeling, rekening houdend met de individuele kenmerken van een patiënt en de eigenschappen van het medicijn of radionuclide. Zo kan een arts de behandeling van bijvoorbeeld kanker optimaliseren of helpen bij de ontwikkeling van nieuwe medicijnen. Een bijkomend voordeel van dat laatste is dat dit model dierproeven of de lengte van klinische proeven in de toekomst zou kunnen verminderen”, zegt Bouwman.
Het model is ontwikkeld op het softwareplatform PhysPK© en laat zien hoe specifieke tumoren en organen het toegediende nucleaire medicijn opnemen. Het medicijne bestaat uit een molecuul (peptide), gecombineerd met een medische isotoop (nucleaire geneeskunde). Deze behandeling wordt peptide receptor radionuclide therapy of PRRT genoemd. “In de tumorcellen zitten specifieke receptoren die binden aan toegediende peptiden. Via deze receptor worden de peptiden met een medische isotoop door de cel opgenomen, waarbij de radioactieve component de tumorcellen beschadigt. Bouwman legt uit: “Het is belangrijk dat tijdens dit proces het radioactieve verval zoveel mogelijk plaatsvindt in tumorcellen, in plaats van in de buurt van gezonde cellen. Dit zal de schade aan ander weefsel beperken en mogelijke bijwerkingen van de behandeling verminderen.”
Het houdt ook rekening met de persoonlijke kenmerken van de patiënt, waardoor het voor elke patiënt de juiste dosering kan bepalen om tot een optimale behandeling te komen. Bouwman: “Elke patiënt is anders. Daarom is het zo waardevol dat we ook de persoonskenmerken van de patiënt in het model kunnen opnemen.”
Het model kan vervolgens worden gebruikt om het effect van de behandeling te voorspellen en ‘personalised medicine’, een behandeling op maat van het individu, helpen mogelijk te maken. Bovendien zullen biokinetische computersimulaties in de toekomst het onderzoek naar nieuwe nucleaire geneeskunde ondersteunen. “Het computermodel kan de effecten van het nieuwe medicijn op het lichaam voorspellen. Mogelijk kan het testen op mens en dier gedeeltelijk vervangen.”
“Zodra het model volledig functioneel is, kunnen we de behandeling van de patiënt optimaliseren en ons uiteindelijke doel bereiken. De tumor bestrijden en de schade minimaliseren.”
Voordat het model daadwerkelijk kan worden geïmplementeerd in ziekenhuizen en in onderzoek, is verder onderzoek nodig. “Alles wat je modelleert, moet je valideren in het echte leven. Om de voorspelling van het model te vergelijken met echte patiëntgegevens heb ik patiëntgegevens ontvangen van het Nederlands Kanker Instituut (NKI) en deze toegepast op het model. We hebben nu het model kunnen voltooien en de nauwkeurigheid van de voorspellingen kunnen testen. We hebben nog enkele stappen te nemen en parameters af te stemmen om alle voorspellingen goed te krijgen. Maar de resultaten tot nu toe zijn zeer hoopgevend.”
Volgens Bouwman zal het waarschijnlijk nog 10-15 jaar duren voordat het model op grote schaal in ziekenhuizen kan worden ingezet om een radionuclidentherapie op maat toe te kunnen dienen. Andere factoren moeten nog worden meegenomen, zoals verwachte schade aan risico-organen zoals de nieren en tumoren met andere kenmerken. “Als het model eenmaal volledig functioneel is, kunnen we de behandeling van de patiënt optimaliseren en ons uiteindelijke doel bereiken. De tumor bestrijden en de schade minimaliseren.”
Wilt u meer weten over hoe FIELD-LAB u zou kunnen helpen? Neem dan contact met ons op!